Método Científico
Aula 1 - Ciência
Professor Paim
I. Método Científico
O método científico é um conjunto de regras para produzir conhecimento científico por meio de evidências empíricas verificáveis. Envolve observação sistemática, controle e análise lógica. Inclui métodos como indutivo, dedutivo, hipotético-dedutivo e fenomenológico. Para muitos autores, o método científico é simplesmente a aplicação da lógica à ciência...
.
Etapas do método científico
Observação: o cientista faz observações sobre o fenômeno que deseja estudar, coletando informações e dados relevantes.
Formulação de uma pergunta: com base nas observações feitas, o cientista formula uma pergunta sobre o fenômeno que deseja investigar.
Revisão da literatura: o cientista revisa a literatura existente sobre o assunto, buscando informações e dados relevantes para a pergunta formulada.
- Formulação de hipóteses: com base nas observações e na revisão da literatura, o cientista formula uma ou mais hipóteses, ou seja, possíveis explicações para a pergunta formulada.
Teste das hipóteses: o cientista desenvolve um experimento ou estudo para testar as hipóteses formuladas. Isso pode envolver a coleta de mais dados ou informações, realização de experimentos controlados, análise de amostras, etc.
Análise dos dados: o cientista analisa os resultados do experimento ou estudo, comparando-os com as hipóteses formuladas.
Conclusão: com base na análise dos dados, o cientista pode concluir que uma hipótese é apoiada ou refutada. Se uma hipótese é refutada, o cientista pode formular novas hipóteses e repetir o processo. Se uma hipótese é apoiada, o cientista pode usá-la para formular novas perguntas e continuar a investigação.
Comunicação: o cientista comunica suas descobertas e conclusões para a comunidade científica e o público em geral, muitas vezes através de artigos científicos publicados em revistas especializadas.
* Essa é uma versão ampliada do método científico, normalmente ele é apresentado em 6 etapas, são elas: Observação, Elaboração do problema, Levantamento de hipóteses, Experimentação, Análise dos resultados, Conclusão.
Nossos ancestrais usavam o método científico?
Embora nossos ancestrais mais primitivos possam ter usado processos de pensamento semelhantes ao método científico para aprender sobre o mundo natural e encontrar formas de sobreviver e prosperar, eles não utilizavam a abordagem sistemática e formalizada que entendemos hoje em dia como o método científico moderno.
Os seres humanos pré-históricos podem ter observado cuidadosamente os padrões climáticos, os movimentos dos animais e as propriedades medicinais de plantas e ervas, formulando hipóteses sobre como esses fenômenos funcionavam e testando suas hipóteses por meio de experimentação e observação. No entanto, essas práticas não eram organizadas de forma sistemática ou rigorosa, como é o caso do método científico moderno. Além disso, a maioria dos conhecimentos e informações era transmitida oralmente, o que dificultava a documentação e a replicação dos experimentos.
O método científico moderno, tal como o conhecemos hoje, é um produto do desenvolvimento da ciência ao longo dos séculos. A abordagem sistemática e formalizada envolve a observação cuidadosa, a formulação de hipóteses testáveis, a coleta e análise de dados e a revisão e refinamento das hipóteses à medida que novas evidências surgem. Essa abordagem permite que os cientistas façam previsões precisas sobre o mundo natural e desenvolvam novas tecnologias e terapias para melhorar nossas vidas.
Os seres humanos pré-históricos podem ter observado cuidadosamente os padrões climáticos, os movimentos dos animais e as propriedades medicinais de plantas e ervas, formulando hipóteses sobre como esses fenômenos funcionavam e testando suas hipóteses por meio de experimentação e observação. No entanto, essas práticas não eram organizadas de forma sistemática ou rigorosa, como é o caso do método científico moderno. Além disso, a maioria dos conhecimentos e informações era transmitida oralmente, o que dificultava a documentação e a replicação dos experimentos.
O método científico moderno, tal como o conhecemos hoje, é um produto do desenvolvimento da ciência ao longo dos séculos. A abordagem sistemática e formalizada envolve a observação cuidadosa, a formulação de hipóteses testáveis, a coleta e análise de dados e a revisão e refinamento das hipóteses à medida que novas evidências surgem. Essa abordagem permite que os cientistas façam previsões precisas sobre o mundo natural e desenvolvam novas tecnologias e terapias para melhorar nossas vidas.
Roger Bacon
Roger Bacon foi um dos principais filósofos ingleses da Idade Média e ficou conhecido postumamente como Doutor Mirabilis – 'Dr. Miraculous'. A partir do século XIX, ele foi considerado um dos primeiros expoentes do método científico moderno, com base no fato de acreditar que a natureza deveria ser estudada por meio de observação cuidadosa. O interesse particular de Bacon pela alquimia – cujas atividades principais eram tentar transformar metais básicos em ouro e no elixir que conferiria juventude e vida longa – é mais difícil de conciliar com a ciência moderna, mas muitas pessoas estavam interessadas nisso na época (e Sir Isaac Newton ainda era duro nisso mais de quatrocentos anos depois), e a alquimia logo se transformou no que chamamos de química.
Além de tentar enriquecer rapidamente extraindo ouro do chumbo, Bacon também se interessava por questões relativas à óptica e à forma como vemos as coisas. Como é que, perguntou Roger, podemos ver coisas que estão longe de nós? Como a imagem chega até nós? A resposta, disse ele, é que cópias da imagem emanam misteriosamente do original e viajam pelo espaço até atingirem os olhos e, pronto, é assim que vemos objetos distantes. Qualquer que seja o sentido que isso faça para você, o interesse de Roger pela óptica o levou a inventar os óculos. Este foi realmente um momento visionário, mudando a forma como muitos de nós vemos o mundo.
Sobre o calendário juliano, então ainda em uso, Roger não mediu palavras: o calendário era intolerabilis , horribilis e derisibilis , ou seja, intolerável, horrível e risível. Apesar da campanha de Roger pela reforma do calendário, o calendário juliano irremediavelmente falho permaneceu em uso até 1582. Derisibilis !
René Descartes
dados
Falecimento: 11 de fevereiro de 1650, Estocolmo, SuéciaInfluenciou: Immanuel Kant, Isaac Newton, Gottfried Leibniz, MAISInfluência de: Tomás de Aquino, Arquimedes, Isaac Beeckman, MAISFormação: Universidade de Poitiers (1614–1616), MAISFilhas: Francine Descartes
principais ideias de descartes
O Discurso sobre o Método, obra de 1637 de Descartes, é um tratado filosófico e matemático que lançou as bases do racionalismo como a única fonte de conhecimento.
Acreditava na existência de uma verdade absoluta, incontestável. Para atingi-la desenvolveu o método da dúvida, que consistia em questionar todas as ideias e teorias preexistentes.
Expõe 4 regras para se chegar ao conhecimento:
- Nada é verdadeiro até ser reconhecido como tal;
- Os problemas precisam ser analisados e resolvidos sistematicamente;
- As considerações devem partir do mais simples para o mais complexo;
- O processo deve ser revisto do começo ao fim para que nada importante seja omitido.
Inicialmente, o filósofo duvida dos sentidos, pois o sentidos podem ser fontes de engano
A seguir, chama a atenção para a impossibilidade de reconhecer um sonho. Deste modo, tudo o que chamamos de realidade pode ser apenas elementos integrantes de um sonho.
Mas, percebe que mesmo nos sonhos as regras matemáticas não são alteradas. Descartes afirma que a matemática é um conhecimento um pouco mais puro. Entretanto, podemos estar sob a influência de um gênio maligno, um deus enganador, que nos faz acreditar em certas coisas (por exemplo, 2 + 2 = 4 ou que um triângulo possui três lados).
Descartes convenceu-se de que a única verdade possível era sua capacidade de duvidar, reflexo de sua capacidade de pensar.
Assim, a verdade absoluta estaria sintetizada na fórmula “eu penso”, a partir da qual concluiu sua própria existência. Sua teoria passou a ser resumida na frase “Penso, logo existo” (em latim, Cogito, ergo sum).
Antonie Lavoisier
dados
Nascimento: 26 de agosto de 1743, Paris, FrançaFalecimento: 8 de maio de 1794, Paris, FrançaCônjuge: Marie-Anne Pierrette Paulze (de 1771 a 1794)Formação: Universidade de Paris (1761–1763), Collège des Quatre-Nations (1754–1761)
Apenas aos 25 anos foi eleito membro dessa prestigiosa Academia. Ele se casou aos 26 anos com Marie-Anne, que tinha apenas 13 anos de idade. Porém, ela não se tornou apenas sua esposa, mas também sua assistente. Era ela quem traduzia trabalhos científicos e filosóficos para as pesquisas de Lavoisier.
Na imagem abaixo vemos um retrato famoso de Marie-Anne inclinada sobre Lavoisier com a mão levemente pousada sobre o seu ombro. Enquanto ele está com o rosto meio virado, contemplando Marie-Anne.
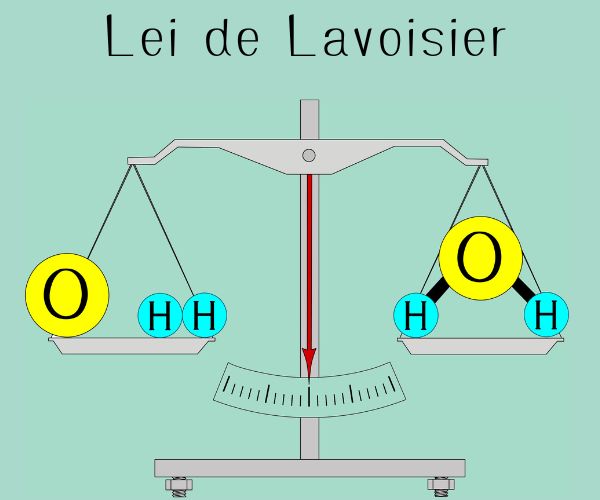
Lavoisier é muitas vezes chamado de o “pai da Química Moderna”. Isso se deve ao modo de trabalhar detalhista que Lavoisier adotou e que serviu de modelo para os próximos cientistas. Ele era muito cuidadoso, anotando suas observações de forma detalhada, planejando muito bem seus experimentos. Além do aspecto qualitativo, ele também relacionava precisamente o aspecto quantitativo dos experimentos, pois fazia bom uso de balanças, realizando pesagens e medições cuidadosas.
![Balança usada por Lavoisier Balança de pratos usada por Lavoisier[1]](https://www.biologianet.com/upload/conteudo/images/2014/12/balanca-usada-por-lavoisier.jpg) Balança de pratos usada por Lavoisier[1]
Balança de pratos usada por Lavoisier[1]
Tudo isso fez com que ele conseguisse explicar fatos que outros cientistas não conseguiram. Por exemplo, ele conseguiu relacionar o processo de respiração com o processo de combustão, pois o gás que ele denominou de "oxigênio" era essencial nesses dois processos. Esse nome vinha do grego oxy, que significa “ácido”, e gen, “gerador ou produtor”.
Por Jennifer Rocha Vargas Fogaça Artigos Relacionados
Acreditava na existência de uma verdade absoluta, incontestável. Para atingi-la desenvolveu o método da dúvida, que consistia em questionar todas as ideias e teorias preexistentes.
Expõe 4 regras para se chegar ao conhecimento:
Apenas aos 25 anos foi eleito membro dessa prestigiosa Academia. Ele se casou aos 26 anos com Marie-Anne, que tinha apenas 13 anos de idade. Porém, ela não se tornou apenas sua esposa, mas também sua assistente. Era ela quem traduzia trabalhos científicos e filosóficos para as pesquisas de Lavoisier.
Na imagem abaixo vemos um retrato famoso de Marie-Anne inclinada sobre Lavoisier com a mão levemente pousada sobre o seu ombro. Enquanto ele está com o rosto meio virado, contemplando Marie-Anne.
Lavoisier é muitas vezes chamado de o “pai da Química Moderna”. Isso se deve ao modo de trabalhar detalhista que Lavoisier adotou e que serviu de modelo para os próximos cientistas. Ele era muito cuidadoso, anotando suas observações de forma detalhada, planejando muito bem seus experimentos. Além do aspecto qualitativo, ele também relacionava precisamente o aspecto quantitativo dos experimentos, pois fazia bom uso de balanças, realizando pesagens e medições cuidadosas.
![Balança usada por Lavoisier Balança de pratos usada por Lavoisier[1]](https://www.biologianet.com/upload/conteudo/images/2014/12/balanca-usada-por-lavoisier.jpg)
Tudo isso fez com que ele conseguisse explicar fatos que outros cientistas não conseguiram. Por exemplo, ele conseguiu relacionar o processo de respiração com o processo de combustão, pois o gás que ele denominou de "oxigênio" era essencial nesses dois processos. Esse nome vinha do grego oxy, que significa “ácido”, e gen, “gerador ou produtor”.





.jpg)

![Laboratório de Lavoisier Laboratório de Lavoisier, Musée des Arts et Métiers, em Paris[2]](https://www.biologianet.com/upload/conteudo/images/2014/12/laboratorio-de-lavoisier.jpg)
Comentários
Postar um comentário